当前位置:首页 >> 注册服务 >> 进口/国产医疗器械注册
国产三类医疗器械申报流程
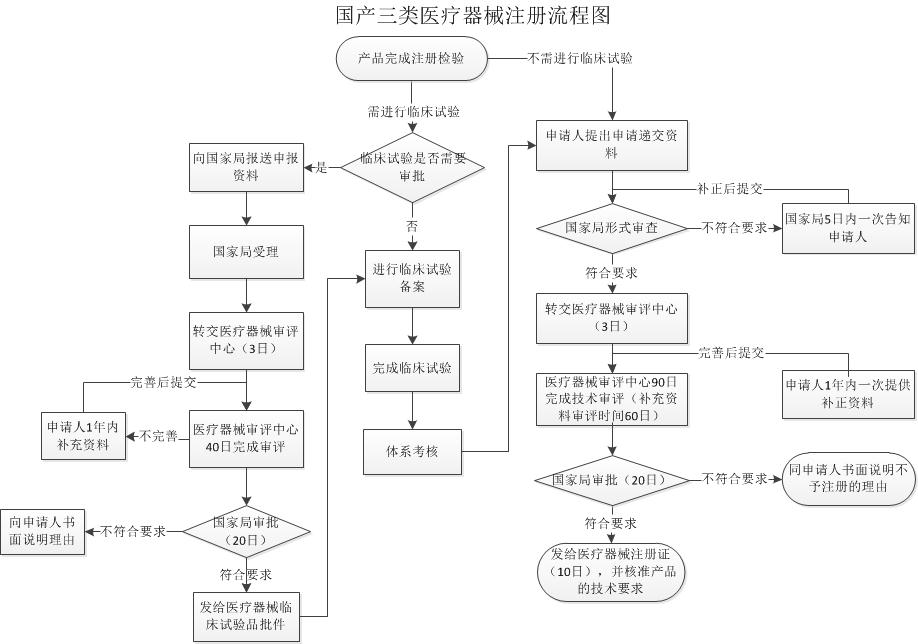
国产三类医疗器械申报资料目录
1.申请表2.证明性文件
2.1企业营业执照副本复印件和组织机构代码证复印件。
2.2按照《创新医疗器械特别审批程序审批》的境内医疗器械申请注册时,应当提交创新医疗器械特别审批申请审查通知单,样品委托其他企业生产的,应当提供受托企业生产许可证和委托协议。生产许可证生产范围应涵盖申报产品类别。
3.医疗器械安全有效基本要求清单
说明产品符合《医疗器械安全有效基本要求清单》各项适用要求所采用的方法,以及证明其符合性的文件。对于《医疗器械安全有效基本要求清单》中不适用的各项要求,应当说明其理由。
对于包含在产品注册申报资料中的文件,应当说明其在申报资料中的具体位置;对于未包含在产品注册申报资料中的文件,应当注明该证据文件名称及其在质量管理体系文件中的编号备查。
4.综述资料
4.1概述
4.2产品描述
4.3型号规格
4.4包装说明
4.5适用范围和禁忌症
4.6参考的同类产品或前代产品的情况(如有)
4.7其他需说明的内容
5.研究资料
5.1产品性能研究
5.2生物相容性评价研究
5.3生物安全性研究
5.4灭菌和消毒工艺研究
5.5有效期和包装研究
5.6动物研究
5.7软件研究
5.8其他
6.生产制造信息
6.1无源医疗器械:应当明确产品生产加工工艺,注明关键工艺和特殊工艺,并说明其过程控制点。明确生产过程中各种加工助剂的使用情况及对杂质(如残留单体、小分子残留物等)的控制情况。
6.2有源医疗器械:应当明确产品生产工艺过程,可采用流程图的形式,并说明其过程控制点。
注:部分有源医疗器械(例如:心脏起搏器及导线)应当注意考虑采用“6、生产制造信息”6.1中关于生产过程信息的描述。
6.3生产场地:有多个研制、生产场地,应当概述每个研制、生产场地的实际情况。
7.临床评价资料
按照相应规定提交临床评价资料。
8.产品风险分析资料
产品风险分析资料是对产品的风险管理过程及其评审的结果予以记录所形成的资料。应当提供对于每项已判定危害的下列各个过程的可追溯性:
8.1风险分析:包括医疗器械适用范围和与安全性有关特征的判定、危害的判定、估计每个危害处境的风险。
8.2风险评价:对于每个已判定的危害处境,评价和决定是否需要降低风险。
8.3风险控制措施的实施和验证结果,必要时应当引用检测和评价性报告,如医用电气安全、生物学评价等。
8.4任何一个或多个剩余风险的可接受性评定。
9.产品技术要求
医疗器械产品技术要求应当按照《医疗器械产品技术要求编写指导原则》的规定编制。产品技术要求一式两份,并提交两份产品技术要求文本完全一致的声明。
10.产品注册检验报告
提供具有医疗器械检验资质的医疗器械检验机构出具的注册检验报告和预评价意见。
11.说明书和标签样稿
应当符合相关法规要求。
12.符合性声明
12.1申请人声明本产品符合《医疗器械注册管理办法》和相关法规的要求;声明本产品符合《医疗器械分类规则》有关分类的要求;声明本产品符合现行国家标准、行业标准,并提供符合标准的清单。
12.2所提交资料真实性的自我保证声明(由申请人出具)。

