현 위치:홈 >> 등록 서비스 >> 수입 의약품 등록 서비스
화학약품 등록 분류 판정표
| 등록분류 | 종류 | 포함된 상황 |
| 국내외에서 출시되지 않는 혁신적 의약품 | 구조가 명확하고 약리 작용을 가지는 새로운 화합물을 포함하는 임상적 가치가 있는 원료의약품과 제제 | |
| 국내외에서 출시되지 않는 개량신약 |
2.1알려진 활성성분은 분리나 합성을 통해 만드는 광학 이성질체, 알려진 활성성분의 에스테르화나 염화(수소 결합이나배위 결합을 포함한 염이 포함됨), 알려진 염류 활성성분을 변화시키는 산기나 알칼로이드나 금속원소, 다른 비공유결(예를 들어, 착화합물, 킬레이트, 내포 화합물)을 형성하고 임상시험에 우위를 가지는 원료의약품이나 관한 제제. 2.2알려진 활성성분을 포함하고 뚜렷한 임상우위를 가지는 새로운 제제(새로운약물 전달 시스템도 포함됨), 새로운 처방공정, 그리고 새로운 약물 전달 방식. 2.3알려진 활성성분을 포함하고 뚜렷한 임상우세를 가지는 새로운 복방제제. 2.4알려진 활성성분을 포함한 새로운 적응증의 제제. |
|
| 국외에 출시되지만 국내에 출시되지 않는 최초 약제의 제네릭(복제의약품) | 최초 약제의 활성성분, 제형, 규격, 적용증, 약물 전달 방식, 용법용량과 같은 원료의약품과 제제. | |
| 국내에 출시되는 최초 약제의제네릭(복제의약품) | 최초 약제의 활성성분, 제형, 규격, 적용증, 약물 전달 방식, 용법용량과 같은 원료의약품과 제제. | |
| 국외에 출시되는 약품은 국내에 등록 출시를 신청함 |
5.1국외에 출시된 최초 약제(원료의약품과 그에 관한 제제가 포함됨)은 국내에 출시 신청을 한다. 5.2국외에 출시된 원료의약품과 그에 관한 제제가(최초 약제이 아닌 약품들) 국내에 출시 신청을 한다. |
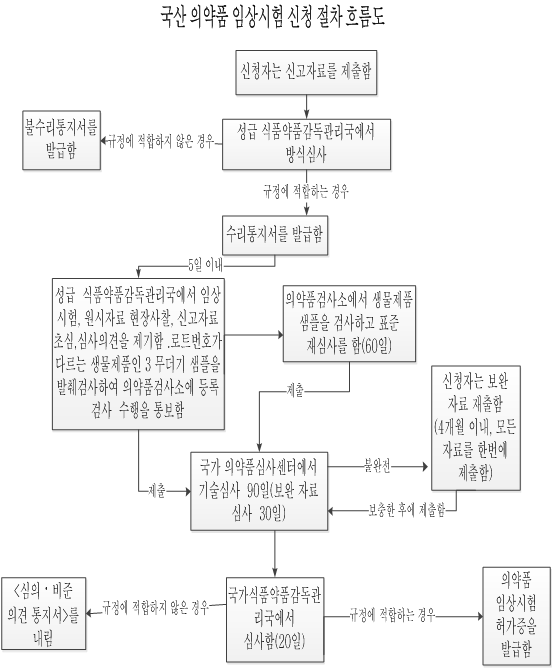
국산 화학약품 임상시험 신청 절차 흐름도
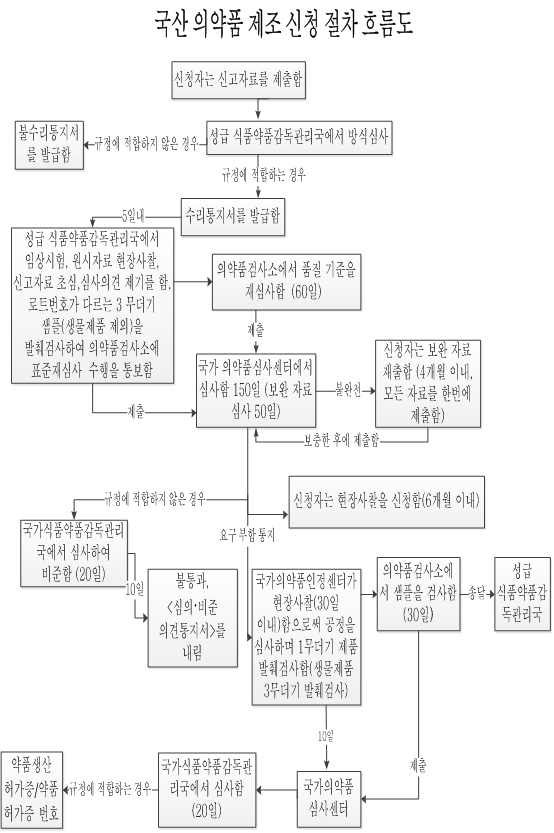
국산 화학약품 제조 신청 절차 흐름도
의약품 등록 신청 구비 서류 리스트
A. 국내.외에서 출시 및 판매된 적이 없는 개량식 신약, 혁신적 약제의 등록 구비 서류 (등록 분류 1,2등급의 의약품 등록 신청 구비 서류 리스트)
1. 개요
1) 의약품 명칭;
2) 증명성 문서;
3) 신고 목적과 근거 (국내.외에서 출시 및 판매된 적이 없는 개량식 신약의 경우 신청인은 기술 창의성 및 임상 가치가 원 종류에 비해 언떤 우세 있는지 확실히 설명해야 한다);
4) 의약품 설명서, 기초 설명 및 관련 문헌;
5) 포장, 라벨 설계도.
2. 연구 자료 종합표
1. 약학 연구 자료 종합표;
2. 비임상 연구 자료 종합표;
3. 임상 연구 자료 종합표.
3. 약학 연구 자료
3.2.S원료의약품;
3.2.S.1기초정보;
3.2.S.2생산정보;
3.2.S.3특성평가;
3.2.S.4원료의약품에 대한 품질 관리;
3.2.S.5기준 물질;
3.2.S.6포장 재질 및 용기;
3.2.S.7안정성;
3.2.P.1제형 및 제품 구성;
3.2.P.2제품 개발;
3.2.P.3생산;
3.2.P.4원료 및 보조재에 대한 관리;
3.2.P.5제제의 품질 관리;
3.2.P.6기준 물질;
3.2.P.7안정성.
4. 비임상 연구 자료
1) 약리학 시험 자료 및 문헌 자료;
2) 비임상 약물동태학 시험 자료 및 문헌 자료;
3) 비임상 안전성 시험 자료 및 문헌 자료.
5. 임상 연구 자료
1) 임상 연구 계획 및 연구 방안;
2) 임상 연구자 자료;
3) 사전 동의서 원고, 윤리 위원회의 허가서; 제안:과학위원회 심사보고를 추가;
4) 임상시험 종합적인 서술;
5) 임상시험 보고서.
B. 경외에서 출시 및 판매되고 중국 국경 내에서 출시 및 판매된 적이 없는 최초 약제을 복제한 의약품의 등록 구비 서류
(등록 분류 3등급 의약품의 등록 신청 구비 서류 리스트)
1. 개요
1) 의약품 명칭;
2) 증명성 문서;
3) 신고 목적과 근거;
4) 의약품 설명서, 기초 설명 및 관련 문헌;
5) 포장, 라벨 설계도.
2.약학 연구 자료
2.3.S 주요 연구결과의 총결 (원료의약품);
3.2.S.1기초정보;
3.2.S.2생산정보;
3.2.S.3특성평가;
3.2.S.4원료의약품에 대한 품질 관리;
3.2.S.5기준 물질;
3.2.S.6포장 재질 및 용기;
3.2.S.7안정성;
2.3.P 주요 연구결과의 총결 (제제);
3.2.P.1 제형 및 제품 구성;
3.2.P.2 제품 개발;
3.2.P.3 생산;
3.2.P.4 원료 및 보조재에 대한 관리;
3.2.P.5 제제의 품질 관리;
3.2.P.6 기준 물질;
3.2.P.7 안정성.
3.약리(藥理)독성(毒理) 연구 자료
1) 비임상 연구 개술과 결과 및 평가
2) 약리학 시험 자료 및 문헌 자료;3) 비임상 약물동태학 시험 자료 및 문헌 자료;
4) 비임상 안전성 시험 자료 및 문헌 자료.
4.임상 연구 자료
1) 임상 연구 계획 및 연구 방안;
2) 임상 연구자 자료;
3) 사전 동의서 원고, 윤리 위원회의 허가서; 제안:과학위원회 심사보고를 추가;
4) 임상시험 종합적인 서술;
5) 임상시험 보고서;
6) 의약품 설명서, 기초 설명 및 관련 문헌.
C. 중국 국경 내에서 출시 및 판매된 최초 약제을 복제한 의약품의 등록 구비 서류
(등록 분류 4등급 의약품의 등록 신청 구비 서류 리스트)
1. 개요
1) 의약품 명칭;
2) 증명성 문서;
3) 신고 목적과 근거;
4) 의약품 설명서, 기초 설명 및 관련 문헌;
5) 포장, 라벨 설계도.
2. 원료의약품
1.S.파일 관리(법규 요구에 따라 원료의약품의 관련 자료를 제공함);
2.3.S약학 연구 자료 종합표;
3.2.S.1기초정보;
3.2.S.2생산정보;
3.2.S.3특성평가;
3.2.S.4원료의약품에 대한 품질 관리;
3.2.S.5기준 물질;
3.2.S.6포장 재질 및 용기;
3.2.S.7안정성.
3. 제제
1.P.파일 관리(법규 요구에 따라 제제의 관련 자료를 제공함);
2.3.P.약학 연구 자료 종합표;
2.4.P.약리(藥理)독성(毒理) 연구 자료 종합표;
2.5.P.인체 생물학적 동등성 연구 자료 종합표;
2.6.P.약물동태학 총결(리포솜、마이크로스피어등 특수 제제 적용);
3.2.P.1제형 및 제품 구성;
3.2.P.2제품 개발;
3.2.P.3생산;
3.2.P.4원료 및 보조재에 대한 관리;
3.2.P.5임상시험/BE시험 견본의 생산 상황;
3.2.P.6제제의 품질 관리;
3.2.P.7기준 물질;
3.2.P.8안정성.
4.약리(藥理)독성(毒理) 연구 자료
5.생물학적 동등성 연구 자료
1) 생물학적 동등성 시험에 사용하는 견본의 처방 및 생산규모;
2) 다른 규격 제품의 생물학적 동등성 시험;
3) 생물학적 동등성 시험 설계 및 실시;
4) 시험대상자;
5) 방안를 빗나감;
6) 안전성 평가.

