仿制药一致性评价
1. 仿制药一致性评价流程
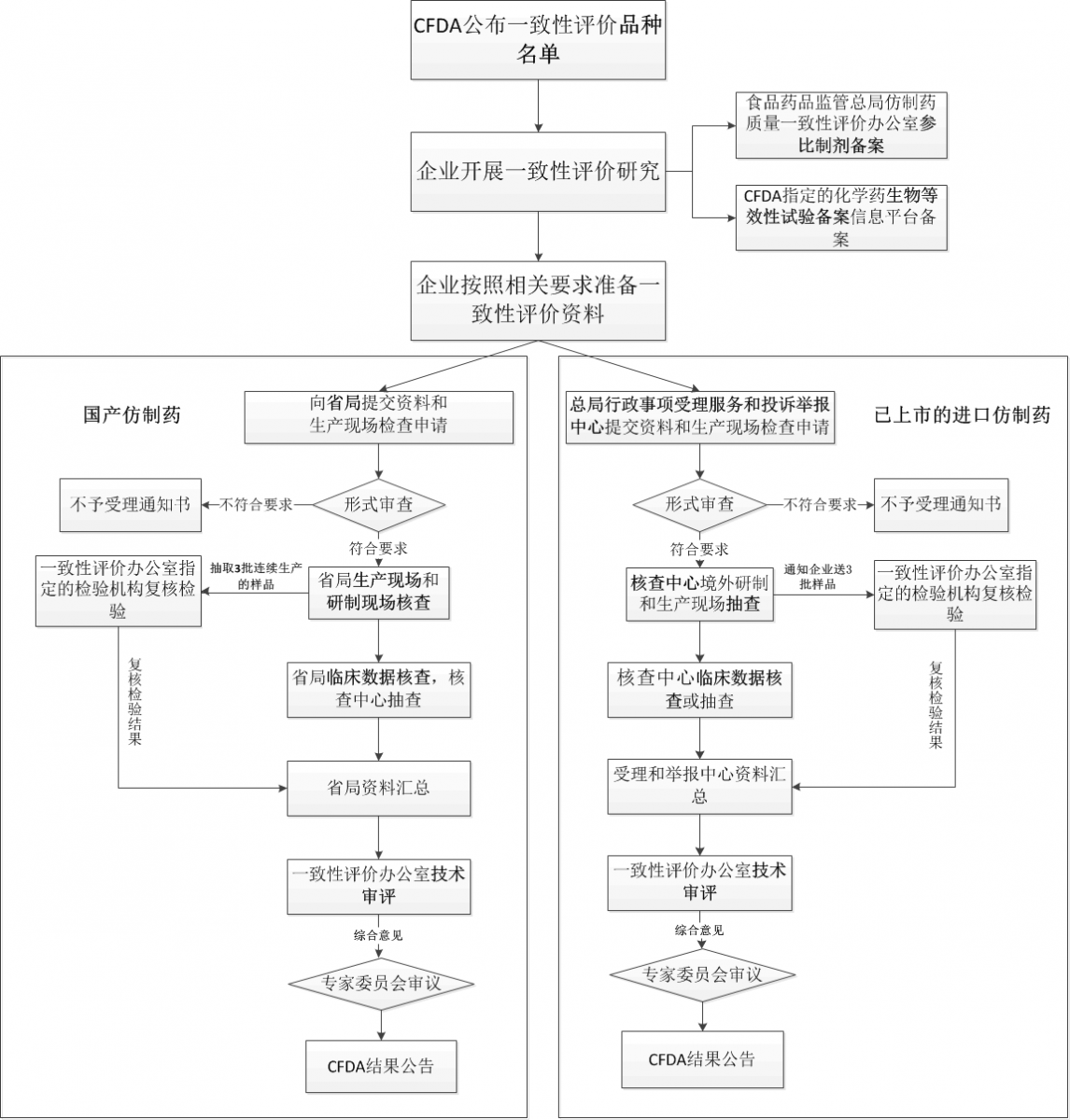
2. 化药仿制药口服固体制剂一致性评价申报资料要求
第一部分:研究资料信息汇总表(研究综述部分)
一、目 录
1.1 品种概述
1.2 剂型与产品组成(CDE格式为2.3.P.1)
1.3 产品再评价研究(参照CDE资料 “3.2.P.2 产品开发”)
1.4 生产(参照CDE资料3.2.P.3,删去与注射剂相关的叙述)
1.5 原辅料的控制
1.6包装材料(基本同3.2.P.2.4包装材料/容器,考虑容器主要指注射剂,暂不在题目中强调)
1.7 质量控制(基本同CDE资料3.2.P.6制剂的质量控制)
1.8 对照品
1.9 稳定性(参照CDE资料“3.2.P.7稳定性”)
1.10 参比制剂
1.11 体外评价
1.12 体内评价
1.13 综合评价
1.14 参考文献
1.15 附件
第二部分:申报资料撰写要求(药学研究资料部分)
一、目 录
2.1 剂型与产品组成
2.2 产品再评价研究(参照CDE资料 “3.2.P.2 产品开发”)
2.3 生产(参照CDE资料3.2.P.3,删去与注射剂相关的叙述)
2.4 原辅料的控制
2.5 包装材料(基本同3.2.P.2.4包装材料/容器,考虑容器主要指注射剂,暂不在题目中强调)
2.6 质量控制(基本同CDE资料3.2.P.6制剂的质量控制)
2.7 对照品
2.8 稳定性(参照CDE资料“3.2.P.7稳定性”)
2.9 参比制剂
2.10体外评价
2.11 综合评价
2.12 参考文献
2.13 附件
1. 仿制药一致性评价流程

2. 化药仿制药口服固体制剂一致性评价申报资料要求
第一部分:研究资料信息汇总表(研究综述部分)
一、目 录
1.1 品种概述
1.2 剂型与产品组成(CDE格式为2.3.P.1)
1.3 产品再评价研究(参照CDE资料 “3.2.P.2 产品开发”)
1.4 生产(参照CDE资料3.2.P.3,删去与注射剂相关的叙述)
1.5 原辅料的控制
1.6包装材料(基本同3.2.P.2.4包装材料/容器,考虑容器主要指注射剂,暂不在题目中强调)
1.7 质量控制(基本同CDE资料3.2.P.6制剂的质量控制)
1.8 对照品
1.9 稳定性(参照CDE资料“3.2.P.7稳定性”)
1.10 参比制剂
1.11 体外评价
1.12 体内评价
1.13 综合评价
1.14 参考文献
1.15 附件
第二部分:申报资料撰写要求(药学研究资料部分)
一、目 录
2.1 剂型与产品组成
2.2 产品再评价研究(参照CDE资料 “3.2.P.2 产品开发”)
2.3 生产(参照CDE资料3.2.P.3,删去与注射剂相关的叙述)
2.4 原辅料的控制
2.5 包装材料(基本同3.2.P.2.4包装材料/容器,考虑容器主要指注射剂,暂不在题目中强调)
2.6 质量控制(基本同CDE资料3.2.P.6制剂的质量控制)
2.7 对照品
2.8 稳定性(参照CDE资料“3.2.P.7稳定性”)
2.9 参比制剂
2.10体外评价
2.11 综合评价
2.12 参考文献
2.13 附件

